HAYATIN RESMİNİ DOLDURMAK 2017 NOBEL KİMYA ÖDÜLÜ
Nobel Ödülü Nedir? Kimlere Verilir?
Nobel, Alfred Nobel’in 1895 tarihli vasiyeti üzerine; kimya, fizik, edebiyat, barış, ve fizyoloji veya tıp alanlarında olmak üzere beş dalda seçkin katkılarda bulunanlara verilmeye başlanmıştır. Nobel’in vasiyetinde belirttiği gibi, ödül sahibine İsveç Kraliyet Bilimler Akademisi’nin seçtiği beş üyelik komite tarafından karar verilir ve ödül Nobel Vakfı tarafından karşılanır.
Jacques Dubochet Joachim Frank Richard Henderson
Dubochet: 1942’de (İsveç’te) doğdu. Doktora derecesini 1973’te İsviçre’deki Cenevre ve Basel Üniversitelerinden aldı. Halen İsviçre’deki Lozan Üniversitesi’nde fahri biyofizik profesörü.
Joachim: 1940’ta (Siegen,Almanya) doğdu. Doktora derecesini 1970’te Almanya’daki Münih Teknik Üniversitesi’nden aldı. Halen New York’taki (ABD) Colombia Üniversitesi’nde Biyokimya ve Moleküler Biyofizik ve Biyolojik Bilimler bölümlerinde profesör.
Hendersen: 1945’te (Edinburgh, İskoçya’da doğdu. Doktora derecesini 1969’da Birleşik Krallık’taki Cambridge Üniversitesi’nden aldı. Halen aynı üniversitedeki MRC Moleküler Biyoloji Labaratuarı’nda program lideri.
Bugün araştırmaclar kriyo elektron mikroskopisini kullanarak biyomolekülleri hareket halindeyken dondurabiliyor ve onları atomik çözünürlükte görüntüleyebiliyor. Bu teknoloji biyokimyada yeni bir çağın başlangıcı oldu.
Mikroskopların Tarihçesi
Mikroskop, çıplak gözle görülemeyecek kadar küçük cisimlerin birkaç çeşit mercek yardımıyla büyütülerek görüntünün incelenmesini sağlayan optik sistemdir. Mikroskop; sanayi, endüstri ve genetik vb. alanlarda kullanılmaktadır. Mikroskopların çeşitleri aşağıdaki şekildedir:
*Stereo Mikroskobu; Cisimlerin üç boyutlu görüntüleri elde edilir. Polarizasyon mikroskobu ve faz kontrast mikroskobu olmak üzere ikiye ayrılır.
*İnterferans Mikroskobu; Faz kontrast mikroskobunun iyi versiyonudur. Aralarındaki tek fark ışık demetinin kulanımıdır. (Kırılma indisi farklılıkları)
*Metalurji Mikroskobu
*Elektron Mikroskobu; Cisimden saçılan elektronların görüntülenmesi mantığıyla çalışır. Maddeyle etkili elektronların dalga boyu bu görüntülerin nanometre boyutlarında yapılmasını sağlar. Bu tip mikroskoplar elektron enerjisine ve ölçüm aletinin çalışma moduna göre, geçirimli elektron mikroskobu, taramalı elektron mikroskobu, düşük enerjili elektron mikroskobu olarak farklı sınıflara ayrılır.
*Karanlık Alan Mikroskobu
*Fluorances Mikroskobu
*X -Ray Mikroskobu; Işıkların rastladıkları partiküllerle çarpışmaları sonucu yönlerini değiştirmesi sonucu oluşan görüntü mantığı ile çalışır.
*Eş Odaklı Lazer Tarama Mikroskobu
*Saha Emisyon Mikroskobu
*Atomik Kuvvet Mikroskobu
*Cevher Mikroskobu
1896 yılı Nobel Fizik Ödülü sahibi Ernst Ruska tarafından tasarlanan elektron mikroskobu ışık yerine kullandığı için çözünürlüğü elektron ışını hem içlerinden geçerken molekülleri harap ediyor hem de yeterince kontrast oluşmuyordu. Doz azaldığında ise sinyal gürültü oranı bozuluyor ve elektron ışınının etkisiyle örnek hareket ediyordu. Ayrıca kayıt ortamına zorunlu olarak vakum uygulandığındaörnekler kuruyup çöküyor ve doğal yapıları bozuluyordu. Bu yüzden yıllarca elektron mikroskobunun atomik çözünürlükteki biyolojik örneklere uygulanabildi. Elekron mikroskobunun atomik çözünürlükteki biyolojik örneklere uygulanabilmesi için yeni örnek hazırlama yöntemleri geliştirilmeliydi.
Geçtiğimiz yıllarda bilimsel çalışmalardaki yenilikler hayranlık uyandırıcı görüntülerle dolup taştı. Samonella bakterisinin hücrelerde saldırmak için kullandığı enjeksiyon iğnesi; kemoterapiye ve antibiyotiklere direnç sağlayan proteinle; sirakdiyan ritmleri yöneten moleküler kompleksler vs. gibi örnekler mevcuttur.

Geçtiğimiz birkaç yıl içinde araştırmacılar çok sayıda karmaşık protein kompleksinin atomik yapılarını yayımladı. a. Sirkadiyan ritmi yöneten bir protein kompleksi b. Kulakta basınç değişimlerini algılayarak işitmemizi sağlayan bir algılayıcı c. Zika virüsü
Biyomoleküllerin dalgalı ve sarmallı yapılarının görüntülenebilmesi ancak Cambridge’deki araştırmacıların 1950’lerde protein kristallerini X-ışınlarının kullanılarak incelemeye başlamasıyla mümkün oldu.
1980’lerin başında proteinlerin katı halde ve çözelti içinde incelelenmeleri için X ışını kristalografisi kullanımı nükleer manyatik rezonans (NMR) spektroskopisi kullanımıyla destekleniyordu. Bu yöntem proteinlerin yapısını ortaya çıkarmakla kalmayıp nasıl hareket ettikerini ve başka moleküllerle nasıl etkileştiklerini de ortaya çıkarıyor.
Bugün bu iki yöntem sayesinde biyomeleküllerin binlerce modelini barındıran ve temel araştırmalardan ilaç geliştirme çalışmalarına kadar çok çeşitli amaçlara hizmet eden veri tabanları vardır. Ancak her iki yöntemin de temel kısıtlılıkları var. Çözeltide uygulanan NMR sadece bazı proteinler için işe yarıyor. X-ışını kristalografisi de tıpkı su buza dönüştüğü gibi moleküllerin düzenli kristaller oluşturmasını gerektiriyor. Görüntülerse ileri fotoğraf makineleriyle elde edilen siyah beyaz fotoğrafları andırıyor, hareketsiz pozlar proteinin özellikleri ile iligili çok az bilgi veriyor.
Ayrıca pek çok molekülün kendini kristal biçiminde düzenlemesi mümkün değil ki bu Richard Henderson’ın 1970’lerde X-ray kristalografisinden vazgeçmesine neden oldu. Ve işte 2017 Nobel Kimya Ödülü’nün öyküsü böyle başladı.
Richard Hendorsen doktorasını Cambridge Üniversitesi’nde X-ray Kristalografisi üzerine yaptı. Yöntemi proteinleri görüntülemek için kullandı. Henderson’ın üzerinde ilk çalıştığı protein gerekli miktarda üretilmesi zor bir proteindi; ikinci protein ise kristalleştirilemiyordu. Yıllar süren hayal kırıklıklarının ardından Henderson var olan tek alternatife yöneldi: Elektron mikroskobu.
Gönderilen elektron ışının dalga boyu ışığınkinden çok daha kısa olduğu için elektron mikroskobu çok küçük yapıları hatta tek tek atomların konumlarını konumlarını görünür hale getirebiliyor.
1930’larda icat edildiğinde bilim insanları elektron mikroskobunun sadece ölü maddeyi incelemek için uygun olduğunu düşünüyordu. Yüksek çözünürlüklü görüntüler elde etmek için gerekli yoğun elektron ışını biyolojik malzemeleri küle çeviriyordu, ışın zayıflatıldığında ise görüntü kontrast kaybına uğrayıp bulanıklaşıyordu.
Porojede onun incelemek üzere özel bir proteini, bakteriyorodopsini seçmesi sayesinde başarısızlıktan kurutuldu.
Bakteriyorodopsin: Fotosentez yapan bir organizmanın hüzre zarına gömülü halde duran, mor renkli bir proteindir.

Hassas proteini hücre zarından ayırmak yerine mor hücre zarını bütün halinde alıp elektron mikroskobunun altına yerleştirdi. Protein hücre zarıyla çevrelenmiş halde kalınca yapısını korudu; araştırma ekibi vakum altında kurumasını önlemek için örneğin yüzeyini bir glikoz çözeltisiyle kapladı. Tam doz elektron bombardımanına tutmak yerşne örneğe daha zayıf birr elektron ışını gönderdiler. Görüntünün kontrastı düşütü ve atomları ayrı ayrı göremiyorlardı proteinlerin hücre zarı içimde düzenli bir şekilde istiflenmiş olması ve aynı doğrultuda bulunması gerçeğini kullandılar.
Sonraki aşamada araştırmacılar elektron mikroskobu altındaki hücre zarını çevirerek farklı açılardan görüntüler aldı. Bu yolla 1975’twe bakteriyorodopsinin yapısını gösteren üç boyut bir taslak model oluşturuldu.
7 Angström’luk çözünürlük
Bu bir proteinin o zamana kadar bir elektron mikroskobuyla elde edilmiş en iyi görüntüsüydü. X-ışını kristalografisiyle elde edilen yalaşık 3 Angström’luk çözünürlüğe ulaşmaktı.
Daha iyi mercekler üretimeye başlandı ve örneklerin ölçümler sırasında sıvı azot soğutularak elektron ışınlarının zararlı etkilerinden korunmasını sağlayan biyoteknoloji gelişti.
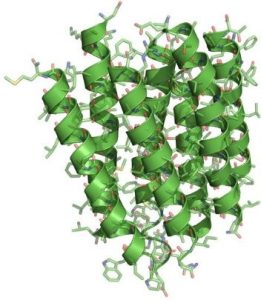 1990’da, ilk modeli yayımlamasından 15 yıl sonra Henderson amacına ulaştı ve bakteriyorodopsinin atomik çözünürlükte bir görüntüsünü ortaya çıkarabildi.
1990’da, ilk modeli yayımlamasından 15 yıl sonra Henderson amacına ulaştı ve bakteriyorodopsinin atomik çözünürlükte bir görüntüsünü ortaya çıkarabildi.
*Yan taraftaki resim Henderson’ın 1990’da bakteriyodopsinin atomik çöznürlükteki yapısını ortaya koydunu ifade ediyor.
Böylece cryo-EM’nin (kriyo elektron mikroskobu) X-ışını kristalografisiyle elde edilenler kadar ayrınıtılı görüntüler üretebildiğini kanıtlamış oldu. Elektron mikroskobuyla örnek içinde ratgele dağılmış halde olan ve farklı doğrultularda bulunan proteinlerin üç boyutlu görüntüleri elde edilebilir miydi?
Atlantiğin diğer tarafında, New York Eyalet Sağlık Dairesi’nde Joachim Frank tam da bu probleme çözüm bulmak için uzun zamandır çalışmaktaydı. 1975’te elektron mikroskobuyla elde edilen iki boyutlu görüntülerin sahip olduğu görünürde minimal düzeydeki bilgilerin yüksek çözünürlüklü üç boyutlu bir bütün oluşturmak üzere birleştireleceği kuramsal bir strateji ortaya koydu.
Joachim Frank’ın stratejisi bir bilgisayarın bulanık bir eleketron mikrosbu görüntüsünde rastgele konumlanmış proteinlerin izlerini arka plandan ayırt etmesine dayanıyordu. Frank bilgisayarın görüntüdeki yineleyen farklı desenleri belirlemesini sağlayan matematiksel bir yöntem geliştrdi.
 Bilgisayar benzer desenleri aynı grupta topluyor ve bu görüntülerdeki bilgileri birleştirerek ortalama ve daha net bir görüntü oluşturuyordu. Aynı alanda yapılan çalışmalarla proteini farklı açılardan gösteren bir dizi yüksek çözünürlüklü, iki boyutlu görüntü elde etti. Yazılımı oluşturan algoritmalar 1981’de tamamlandı. Amaç iki boyutlu farklı görüntülerin birbirleriyle nasıl ilintili olduğunu belirlemek ve buna dayalı olarak üç boyutlu bir görüntü oluşturmaktı.
Bilgisayar benzer desenleri aynı grupta topluyor ve bu görüntülerdeki bilgileri birleştirerek ortalama ve daha net bir görüntü oluşturuyordu. Aynı alanda yapılan çalışmalarla proteini farklı açılardan gösteren bir dizi yüksek çözünürlüklü, iki boyutlu görüntü elde etti. Yazılımı oluşturan algoritmalar 1981’de tamamlandı. Amaç iki boyutlu farklı görüntülerin birbirleriyle nasıl ilintili olduğunu belirlemek ve buna dayalı olarak üç boyutlu bir görüntü oluşturmaktı.
Joachim Frank’ın görüntü işleme yöntemi cryo-EM gelişiminde çok önemli rol oynadı. 1978’te Frank bilgisayar programlarını kusursuzlaştırmaya çalışmaktayken Dubochet, Heidelberg’deki (Almanya) Avrupa Moleküler Biyoloji Labaratuarı’nda işe başlamış ve elektron mikroskobunun bir başka temel problemine odaklanmıştı: Vakumla ortamdaki biyolojik örneklerin kuruyup zarar görmesi.
Henderson 1975’te hücre zarının kurumasını önlemek için glikoz çözeltisi kullanmıştı ancak bu yöntem suda çözünen biyomoleküllerde işe yaramıyordu.
Ancak Dubochet potansiyel bir çözüm buldu: Suya sıvı haliyle katılaştırmak yani kristal yerine cam oluşturulmasını sağlayacak kadar hızlı soğutmak. Cam, katı gibi görünse de aslında sıvı bir maddedir, çünkü molekülleri düzensiz haldedir. Dubochet eğer sudan cam (camlaştırılmış su da deniyor) oluşturmayı başarırsa elektron ışınının dengeli şekilde kırınımına uğrayıp düzenli bir arka plan oluşturulabileceğini farketti.
Araştırma grubu ilk başta minik su damlalarını -196 derecedeki sıvı azotta camlaştırmaya çalıştı. Ancak azot yerine sıvı azot yardımıyla soğuttukları etan kullandıklarında başarılı oldular. Önce bunun etan olduğunu sandılar. Ancak damlayı hafifçe ısıttıklarında moleküller birden aşina oldukları buz kristali yapısına büründü. Bugün suyun evrende en yaygın bulunan halinin camlaşmış su olduğu sanılıyor.
1982’deki büyük ilerlemeden sonra Dubochet’nin araştırma grubu hızla cryo-EM’de hala kullanılan bir tekniğin temellerini geliştirdi. Başlangıçta çeşitli biçimlerdeki virüslerden oluşan biyolojik örneklerini suda çözdüler. Daha sonra çözeltiyi ince bir metal kafes üzerine ince bir film şekilde sıvı etana batırarak suyun camlaşmasını sağladılar.
Jaques Dubochet 1984’te yuvarlak ve altıgen yapıdaki farklı bir dizi virüsün ilk görüntülerini yayımladı.
Sonuçta cryo-EM’in en önemli parçaları yerine oturmuştu ancak görüntülerin çözünürlükleri hala düşüktü. 1991’de Joachim Frank, Dubochet’nin camlaştırma yöntemini kullanarak ribozom örnekleri hazırladı ve görüntüleri kendi yazılımını kullanarak analiz etti. 40 Angström’luk çözünürlüğe sahip üç boyutlu yapı modelleri oluşturdu. Bu elektron mikroskopisi için müthiş bir gelişmeydi ancak görüntü sadece ribozomun dış hatlarını gösteriyordu.
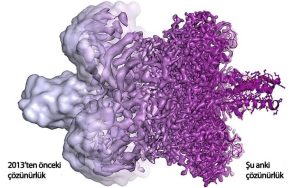 Cryo-EM’lerin düzensiz bir yüzey dışında bir görüntü elde etmek pek mümkün değildi. Bu yüzden Frank’in bu görüntüleri bir su damlasınınkine benzetmesinden yola çıkılarak “bloboloji” ( ingilizce blob su damlası) diye anılarak alay konusu ediliyordu. Ancak zamanla elektron mikroskobunun pek çok yönü optimize edildi. Çözünürlük Angström Angström arttı ve 2013’te yeni tür bir elektron dedektörünün kullanıma girmesiyle son teknik engel de aşılmış oldu.
Cryo-EM’lerin düzensiz bir yüzey dışında bir görüntü elde etmek pek mümkün değildi. Bu yüzden Frank’in bu görüntüleri bir su damlasınınkine benzetmesinden yola çıkılarak “bloboloji” ( ingilizce blob su damlası) diye anılarak alay konusu ediliyordu. Ancak zamanla elektron mikroskobunun pek çok yönü optimize edildi. Çözünürlük Angström Angström arttı ve 2013’te yeni tür bir elektron dedektörünün kullanıma girmesiyle son teknik engel de aşılmış oldu.
Hızlı soğutma işlemi sayesinde biyomoleküllerin hareket halindeyken dondurulması mümkün oluyor ve araştırmacılar bir sürecin farklı kısımlarını gösteren görüntü dizileri oluşturabiliyor. Böylece proteinlerin nasıl hareket edip başka moleküllerle etkileştiğini gösteren “filmler” üretilebiliyor.
KAYNAKÇA:
https://www.fizikist.com/2017-nobel-kimya-odulunun-sahipleri-belli-oldu/
http://haber.sol.org.tr/bilim/bilim-kulturu/2017-nobel-kimya-odulu-hangi-calismanin-212625
http://www.aoblab.com/urunler/mikroskoplar/mikroskop-tarihcesi
https://sarkac.org/2017/10/2017-nobel-kimya-odulu/
https://www.nobelprize.org/nobel_prizes/chemistry/laureates/2017/popular.html